1.3實驗方法
1)鍍件鍍銅前的準(zhǔn)備。將鑄鐵試樣先用0.5mol/L的鹽酸浸泡5min除銹,用水清洗二次,用砂紙打磨后拋光,用水清洗后烘干備用。
2)鍍銅液的配制。首先稱取10gEDTA,3gCuSO4·5H2O,20g次磷酸鈉配制成1L鍍銅溶液,作為基礎(chǔ)配方,逐漸增大配方中各物質(zhì)的質(zhì)量濃度從而形成不同的配方,再稱取37g四硼酸鈉,15g檸檬酸三鈉加入溶液中作為pH調(diào)節(jié)緩沖液,然后再加入分散劑0.2mg硫脲,0.05g脂肪酸聚氧乙烯醚和0.5g硫酸鎳作為鍍銅液。分別選擇不同pH、t和θ沉積銅層,通過稱量計算鍍層厚度。3)鍍層厚度的測定。采用稱量法檢測鍍層厚度,根據(jù)鍍銅前后的鍍件質(zhì)量差和鍍層面積按公式計算鍍層厚度。
式中:Δm為鍍銅質(zhì)量,g;ρ為銅相對密度,g/cm3;A為鑄鐵表面積,cm2。
4)鍍層檢測。用原子吸收法測定鍍銅層的質(zhì)量分數(shù),用掃描電子顯微鏡(SEM)分析鍍銅層的表面形貌。
2·結(jié)果與討論
2.1鍍銅機理的探討
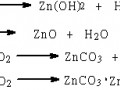
以EDTA為配體,與Cu2+形成穩(wěn)定的配合物:
由于形成了穩(wěn)定的配離子[CuY]2-,在解離平衡中,降低了二價銅離子的濃度,解離出高純度低濃度的銅離子,導(dǎo)致還原反應(yīng)速率降低,所以還原出的金屬銅粒子濃度降低,那么在排列速率一定的條件下,粒子的排列有序性就增加了,還原后的銅粒子可以有序地按一定晶格結(jié)點整齊地排列在鑄鐵表面,從而形成光潔,平整且純度高的鍍銅層。
2.2鍍銅液組成的影響
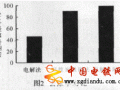
在pH=8.3,鍍液θ為65℃,鍍銅t為40min條件下化學(xué)鍍銅。硫酸銅、次磷酸鈉及EDTA對鍍層厚度的影響分別如圖1、圖2和圖3所示。由圖1、圖2和圖3分別可以看出,當(dāng)ρ(硫酸銅)為7.5g/L,ρ(次磷酸鈉)為38g/L,ρ(EDTA)為20g/L時鍍層厚度均為最大值。
2.3pH對鍍層厚度的影響
以最佳鍍銅液的組成進行化學(xué)鍍銅,在不同pH條件下鍍層的厚度如圖4所示。從圖4中可以看出pH=8.3時鍍層厚度最大。