㈠ 方法簡介
以紫脲酸銨(MX)為指示劑,用EDTA標(biāo)準(zhǔn)滴定溶液直接滴定溶液中的Ni2+ 離子。紫脲酸銨在pH值在7~10的整個(gè)范圍內(nèi),均能獲得很好的顏色轉(zhuǎn)變,而最敏銳和最鮮明的顏色轉(zhuǎn)變是在強(qiáng)堿性溶液中。當(dāng)直接從pH=10開始滴定時(shí),在強(qiáng)堿性溶液中,由于析出氫氧化鎳或堿式鹽引起溶液的混濁;若在強(qiáng)酸性的初始溶液中加入紫脲酸銨會(huì)被迅速水解。因此,先在pH4~6溶液中開始滴定,當(dāng)接近終點(diǎn)時(shí)再調(diào)整pH至10。
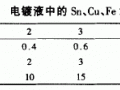
以NH4F-酒石酸鉀鈉掩蔽Fe3+、Al3+、Ca2+、Mg2+ 離子;以Na2S2O3溶液掩蔽Cu2+離子。掩蔽Cu2+離子時(shí),溶液的pH值不能小于3,否則析出的S0↓會(huì)使溶液渾濁無法確定終點(diǎn)。
㈡ 試劑
⑴ 氨水:(1+1)。
⑵ pH10 氨性緩沖溶液。
⑶ Na2S2O3:200 g/L。
⑷ NH4F-酒石酸鉀鈉溶液:將5 g氟化銨、20 g酒石酸鉀鈉溶于去離子水中,搖勻并定容至100 mL。
⑸ EDTA標(biāo)準(zhǔn)滴定溶液:0.05 mol/L。
⑹ 紫脲酸銨(MX)指示劑:m(MX)∶m(NaCl) = 0.1∶50的固體混合物。
㈢ 測(cè)定步驟
移取化學(xué)鍍金液5~10 mL(V1),置于250 mL錐形瓶中,加入10 mL NH4F-酒石酸鉀鈉溶液,滴加氨水(1+1)至pH值4~6,加入50 mL水、10 mL 200 g/L Na2S2O3溶液和0.3 g紫脲酸銨指示劑,用0.05 mol/L的EDTA標(biāo)準(zhǔn)溶液滴至出現(xiàn)橙紅色,加入5 mLpH =10的氨性緩沖液,用EDTA標(biāo)準(zhǔn)溶液繼續(xù)滴定至紫紅色,即為終點(diǎn)(V2 / mL)。
㈣計(jì)算
式中 ρ氯化鎳— 鍍液中氯化鎳(NiCl2·6H2O)的質(zhì)量濃度,g/L;
c— EDTA標(biāo)準(zhǔn)滴定溶液的濃度, mol/L;
V2— EDTA標(biāo)準(zhǔn)滴定溶液的滴定體積,mL;
237.7—氯化鎳(NiCl2·6H2O)的相對(duì)分子量;
V1 — 鍍液的取樣體積,mL。
㈤ 說明
⑴當(dāng)化學(xué)鍍金液中Fe3+、Al3+、Ca2+、Mg2+、Cu2+離子含量較少時(shí),掩蔽劑:NH4F-酒石酸鉀鈉溶液、Na2S2O3溶液可以不加入。當(dāng)化學(xué)鍍金液中Cu2+離子含量較少時(shí),掩蔽劑Na2S2O3溶液可以不加入。
⑵化學(xué)鍍金液中含F(xiàn)e2+離子時(shí),加50 mL水、加10 mL NH4F-酒石酸鉀鈉溶液,10 mL pH =10的氨性緩沖液,滴加30 %的雙氧水3~5滴后,搖勻。加0.3 g紫脲酸銨指示劑,用EDTA標(biāo)準(zhǔn)溶液滴定至紫紅色終點(diǎn)。