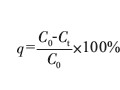HEDP預(yù)鍍銅工藝可獲得性能良好的銅鍍層,且鍍液深鍍能力好,是極具發(fā)展?jié)摿Φ臒o氰預(yù)鍍銅工藝[1-4]。該工藝產(chǎn)生的廢水主要含主絡(luò)合劑HEDP及其與Cu2+形成的絡(luò)合物,還有少量輔助絡(luò)合劑、晶粒細(xì)化劑等其它有機(jī)污染物,因此廢水TP、COD、Cu2+濃度都很高。由于HEDP分子C-P鍵牢固,鍵能為246 kJ·mol-1,化學(xué)性質(zhì)非常穩(wěn)定,在一般光熱條件下不易分解,高溫、高pH條件下也不易水解,抗氧化(如氯氧化)分解性能強(qiáng)[5-6],因此,廢水中HEDP很難去除。HEDP與銅的絡(luò)合物是一種性質(zhì)非常穩(wěn)定的強(qiáng)絡(luò)合物,穩(wěn)定常數(shù)lgK=12.480,比一般的絡(luò)合劑(NH3、EDTA、乙二胺、酒石酸等)與銅離子形成的絡(luò)合物更穩(wěn)定,而且在水中完全以溶解態(tài)存在[4];與游離態(tài)銅離子相比,絡(luò)合態(tài)銅離子很難用常規(guī)的沉淀法(如氫氧化物沉淀法)直接去除。因此,常規(guī)電鍍廢水處理方法很難使HEDP預(yù)鍍銅廢水中主要污染物指標(biāo)(COD、TP、Cu2+),尤其是TP指標(biāo)達(dá)到電鍍污染物排放標(biāo)準(zhǔn)(G B21900-2008)的要求[6],致使廢水處理成為HEDP預(yù)鍍銅新工藝推廣應(yīng)用的瓶頸問題之一。目前關(guān)于該廢水處理技術(shù)的研究報(bào)道較少。
本文采用三價(jià)鐵鹽沉淀-Fenton氧化聯(lián)合新方法處理HEDP預(yù)鍍銅廢水,以COD、TP、Cu2+去除率為指標(biāo),分別考察了各反應(yīng)條件對(duì)處理效果的影響,使廢水中Cu2+、TP、COD指標(biāo)均達(dá)到處理要求,為HEDP預(yù)鍍銅廢水的處理提供一條有效途徑。
1·試驗(yàn)部分
1.1廢水來源及水質(zhì)
試驗(yàn)水樣取自湖南某電鍍廠HEDP鍍銅車間,廢水水質(zhì):COD為1 184 mg·L-1,TP質(zhì)量濃度為767mg·L-1,Cu2+質(zhì)量濃度為172 mg·L-1。其中TP中大部分為有機(jī)磷(占96.7%),主要來源于HEDP,無機(jī)磷比例很小。
1.2試劑和儀器
儀器:UV1100型紫外/可見分光光度計(jì);AY220型電子天平;pH-3C型精密pH計(jì);SHA-C型恒溫振蕩器;HJ-4A型數(shù)顯恒溫多頭磁力攪拌器;WYX-9003A型原子吸收分光光度計(jì);MS-3型微波消解COD測定儀。
試劑:六水合氯化鐵、七水合硫酸亞鐵、過氧化氫(質(zhì)量分?jǐn)?shù)30%)、硫酸、氫氧化鈣。
1.3試驗(yàn)方法
三價(jià)鐵鹽沉淀試驗(yàn):取廢水100 mL于150 mL錐形瓶中,加入FeCl·36H2O后迅速調(diào)節(jié)廢水pH,于磁力攪拌器下攪拌反應(yīng)一定時(shí)間后靜置、過濾,測定濾液中COD、TP、Cu2+等指標(biāo),并計(jì)算三價(jià)鐵鹽沉淀去除率。
Fenton氧化試驗(yàn):取經(jīng)最佳條件下三價(jià)鐵鹽沉淀處理后的濾液100 mL于150 mL錐形瓶中,加入FeSO4·7H2O和H2O2(質(zhì)量分?jǐn)?shù)30%),迅速調(diào)節(jié)pH,于磁力攪拌器下攪拌反應(yīng)一定時(shí)間,再加入Ca(OH)2調(diào)節(jié)pH至8.5后靜置、過濾,測定濾液COD、TP、Cu2+等指標(biāo),并計(jì)算Fenton氧化去除率。
1.4分析方法
TP采用過硫酸鉀消解,鉬銻抗分光光度法測定;Cu2+采用火焰原子吸收分光光度法測定;COD采用微波密封消解法測定。
2·結(jié)果與討論
2.1三價(jià)鐵鹽沉淀試驗(yàn)
HEDP與不同金屬離子絡(luò)合常數(shù)不同,其中HEDP與Fe3+的絡(luò)合常數(shù)為16.21,比HEDP與Cu2+的絡(luò)合常數(shù)更高[4,7-8]。并且,在過量Fe3+存在的條件下,HEDP能與其形成多核絡(luò)合物并進(jìn)一步聚合形成沉淀物[4]。因此,試驗(yàn)試圖向HEDP預(yù)鍍銅廢水投加Fe3+,使Fe3+取代Cu2+并與HEDP形成沉淀物,從而使廢水中的絡(luò)合劑HEDP得到去除;同時(shí)使Cu2+通過共沉淀去除或游離出來。
2.1.1初始pH對(duì)處理效果的影響
在Fe3+投加量900 mg·L-1,反應(yīng)時(shí)間45 min的初始條件下,pH對(duì)三價(jià)鐵鹽沉淀階段處理效果的影響如圖1所示。

由圖1可知,pH小于1.5時(shí),TP、COD去除率隨pH增大而升高,當(dāng)pH為1.5~2.5時(shí),TP、COD去除率最高,均達(dá)到92%以上;pH大于2.5時(shí),隨著pH增大二者的去除率均減小。當(dāng)pH為1.5~5時(shí),Cu2+去除率隨pH增大而升高,pH大于5時(shí),其去除率隨pH增大而降低。推測Fe3+能取代Cu2+與HEDP形成螯合沉淀物[4,7],使廢水中的絡(luò)合劑HEDP得到去除,與此同時(shí),部分Cu2+通過共沉淀去除,但大部分Cu2+被取代后游離出來。在pH為1.5~2.5時(shí),F(xiàn)e3+與HEDP形成沉淀的反應(yīng)占優(yōu)勢;當(dāng)pH從2.5增至5時(shí),該反應(yīng)效率降低,而游離銅可通過形成氫氧化銅沉淀并經(jīng)Fe(OH)3的沉淀網(wǎng)捕作用去除[9],因此隨著pH在該范圍內(nèi)增大,TP和COD去除率減小,而Cu2+去除率升高;pH>5時(shí),由于Fe3+與HEDP形成沉淀的反應(yīng)效率大幅降低,被取代游離出的Cu2+減少,因此Cu2+去除率也開始下降。考慮到后續(xù)處理將對(duì)Cu2+進(jìn)一步沉淀去除,為確保TP、COD的高效去除,確定此階段最佳pH為2.5。
2.1.2 Fe3+投加量對(duì)處理效果的影響
在pH為2.5、反應(yīng)45 min的條件下,F(xiàn)e3+投加量對(duì)沉淀處理HEDP預(yù)鍍銅廢水的影響如圖2所示。由圖2可知,隨著Fe3+投加量增大,TP、COD去除率均升高,當(dāng)Fe3+投加量為1 100 mg·L-1時(shí)二者去除率趨于穩(wěn)定,分別達(dá)到95%和93%以上。這可能是由于當(dāng)Fe3+離子投加量不足時(shí),HEDP與其反應(yīng)形成的沉淀較少。Fe3+離子投加量為700 mg·L-1時(shí)Cu2+去除率達(dá)到40%以上,繼續(xù)增加Fe3+離子投加量,Cu2+去除率反而小幅度減小,這可能是由于Fe3+離子越多,被取代游離出的Cu2+越多,而通過共沉淀去除的Cu2+相對(duì)較少。綜合考慮,確定Fe3+投加量為1 100 mg·L-1。

2.1.3反應(yīng)時(shí)間對(duì)處理效果的影響
在pH為2.5、Fe3+投加量1100mg·L-1的條件下,反應(yīng)時(shí)間對(duì)三價(jià)鐵鹽沉淀處理HEDP預(yù)鍍銅廢水的影響如圖3所示。由圖3可知,反應(yīng)進(jìn)行至10min,廢水中TP、COD、Cu2+去除率分別達(dá)到95%、94%、31%,繼續(xù)增加反應(yīng)時(shí)間,各項(xiàng)指標(biāo)去除率均趨于平緩,故選擇反應(yīng)時(shí)間為10min。此時(shí)COD為64 mg·L-1;TP、Cu2+殘留質(zhì)量濃度分別為33、118 mg·L-1,TP主要以有機(jī)磷存在,有機(jī)磷質(zhì)量濃度為32 mg·L-1。

2.2 Fenton氧化試驗(yàn)
試驗(yàn)結(jié)果表明,廢水經(jīng)三價(jià)鐵鹽沉淀處理后COD已達(dá)到國家電鍍污染物排放標(biāo)準(zhǔn)(GB 21900-2008),但TP和Cu2+仍超標(biāo),因此后續(xù)處理試驗(yàn)主要關(guān)注TP和Cu2+的去除。三價(jià)鐵鹽沉淀處理后廢水中TP主要以有機(jī)磷存在,可能是少量殘余HEDP造成,推測Fenton氧化可能是TP和Cu2+深度去除的有效方法,在Fenton氧化條件下使殘余的HEDP氧化成PO43-、CO2和H2O等物質(zhì),然后通過加堿使PO43-、Cu2+、Fe3+、Fe2+均可形成沉淀得到進(jìn)一步去除。
2.2.1 pH對(duì)處理效果的影響
在H2O(2質(zhì)量分?jǐn)?shù)30%)投加量1mL·L-1,F(xiàn)e2+投加量200mg·L-1,反應(yīng)時(shí)間20min條件下,不同pH對(duì)Fenton氧化處理效果的影響如圖4所示。由圖4可知,pH在1.0~6.0的范圍內(nèi),Cu2+的去除率穩(wěn)定在99.6%左右。TP去除率在pH為1.5~3.0較高,這是由于在Fenton氧化過程中,過低或過高的pH都不利于催化氧化反應(yīng)的進(jìn)行,pH過低會(huì)抑制催化劑的催化再生,使整個(gè)催化反應(yīng)受阻;pH過高,不僅會(huì)抑制自由基的產(chǎn)生,而且使溶液中的催化劑以氫氧化物的形式沉淀而失去催化活性。由于三價(jià)鐵鹽沉淀出水pH為2.5左右,因此進(jìn)行Fenton反應(yīng)時(shí)無需調(diào)節(jié)pH[11-12]。

2.2.2 H2O2投加量對(duì)處理效果的影響
不調(diào)節(jié)三價(jià)鐵鹽沉淀階段出水pH,在Fe2+投加量200 mg·L-1,反應(yīng)時(shí)間20 min的條件下,H2O(2質(zhì)量分?jǐn)?shù)30%)投加量對(duì)處理效果的影響如圖5所示。由圖5可知,Cu2+去除率隨著H2O2投加量增加變化不大。H2O2投加量在0.5~1.5 mL·L-1時(shí),TP去除率最高,達(dá)到98.7%;H2O2投加量過多或過少時(shí)TP去除率均有所下降。結(jié)合處理成本考慮,確定最佳H2O2投加量為0.5 mL·L-1。

2.2.3 m[Fe2+]/m[[H2O2]對(duì)處理效果的影響
不調(diào)節(jié)鐵鹽沉淀階段出水pH,在H2O(2質(zhì)量分?jǐn)?shù)30%)投加量0.5 mL·L-1,反應(yīng)時(shí)間20 min條件下,m[Fe2+]/m[H2O2]對(duì)Fenton氧化處理效果的影響如圖6所示。由圖6可知,Cu2+去除率基本穩(wěn)定,維持在99.6%左右;當(dāng)m[Fe2+]/m[H2O2]從0.25增至1.0,出水中TP去除率逐漸增大,m[Fe2+]/m[H2O2]=1.0時(shí),去除率最大,達(dá)到99.6%。然后,隨著m[Fe2+]/m[H2O2]繼續(xù)增加,TP去除率下降。這是由于當(dāng)m[Fe2+]/m[H2O2]很小時(shí),H2O2難以迅速產(chǎn)生羥基自由基,反應(yīng)速率低;隨著m[Fe2+]/m[H2O2]增大,反應(yīng)逐漸變快;當(dāng)再增大m[Fe2+]/m[H2O2]時(shí),多余的Fe2+被H2O2氧化為Fe3+,消耗了部分H2O2,使得去除效果下降[11-13]。本試驗(yàn)確定最佳m[Fe2+]/m[H2O2]為1:1。

2.2.4反應(yīng)時(shí)間對(duì)處理效果的影響
不調(diào)節(jié)鐵鹽沉淀階段出水pH,在m[Fe2+]/m[H2O2]=1.0,H2O(2質(zhì)量分?jǐn)?shù)30%)投加量0.5 mg·L-1的條件下,反應(yīng)時(shí)間對(duì)Fenton氧化處理效果的影響如圖7所示。由圖7可知,F(xiàn)enton反應(yīng)20 min時(shí),出水TP、Cu2+去除率即分別達(dá)到99.5%和99.7%,繼續(xù)增加反應(yīng)時(shí)間,TP和Cu2+去除率均趨于平緩。故選定反應(yīng)時(shí)間為20 min。

3·結(jié)論
三價(jià)鐵鹽沉淀-Fenton氧化聯(lián)合工藝能有效處理HEDP預(yù)鍍銅廢水,可在去除絡(luò)合銅的同時(shí)高效去除化學(xué)性質(zhì)極穩(wěn)定的HEDP。在優(yōu)化反應(yīng)條件下,三價(jià)鐵鹽沉淀階段TP、COD和Cu2+去除率分別達(dá)到95%、94%、31%,F(xiàn)enton氧化階段分別達(dá)到99.6%、62.0%、99.6%,總?cè)コ史謩e達(dá)到99.97%、97.88%和99.87%,出水中COD為25 mg·L-1,TP、Cu2+質(zhì)量濃度分別為0.17、0.22 mg·L-1,完全達(dá)到電鍍污染物排放標(biāo)準(zhǔn)(GB 21900-2008)要求。三價(jià)鐵鹽沉淀最佳反應(yīng)條件:原水pH為2.5,F(xiàn)e3+投加量1 100 mg·L-1、攪拌時(shí)間10 min;Fenton氧化最優(yōu)條件為:pH為2.5,H2O2投加量0.5 mL·L-1,m[Fe2+]/m[H2O2]=1.0,氧化反應(yīng)時(shí)間20 min。