鍍液分析中氯化鈣代替氯化鋇的實(shí)驗(yàn)和應(yīng)用
馮開文
(天津海林克科技發(fā)展有限公司,天津300384)
摘要:一些鍍液分析需要用到氯化鋇,如測(cè)定氫氧化鈉、碳酸鹽或硫酸鹽等。經(jīng)典的方法是準(zhǔn)確可靠的,但氯化鋇是劇毒試劑,不符合環(huán)保理念。研究了用氯化鈣代替氯化鋇的可行性,分析方法做了相應(yīng)的改變。必須使用氯化鋇時(shí),污水要經(jīng)過處理以減少對(duì)環(huán)境的污染,為和諧社會(huì)造福。
關(guān)鍵詞:氯化鋇;氫氧化鋇;氯化鈣;氫氧化鈣;溶度積
中圖分類號(hào):TG115.31文獻(xiàn)標(biāo)識(shí)碼:B
文章編號(hào):1001-3849(2011)11-0044-03
引言
分析堿性鍍液中氫氧化物時(shí),要加入氯化鋇沉淀碳酸鹽以消除干擾。分析碳酸鹽和硫酸鹽時(shí)用氯化鋇沉淀碳酸鹽和硫酸鹽以作進(jìn)一步測(cè)定[1]。如氰化鍍銅、氰化鍍鋅、鋅酸鹽鍍鋅、堿性鍍錫、氰化鍍銀及鍍鉻等溶液,每個(gè)樣品需要100g/L氯化鋇溶液1.0~15mL,折合氯化鋇1.0~1.5g。可溶性鋇鹽都是劇毒的,氯化鋇對(duì)人的致死量是0.8~0.9g[2],前些年曾經(jīng)與氰化物劃歸一類管理,購(gòu)買困難,因此試驗(yàn)了用氯化鈣代替氯化鋇的可能性。
1·實(shí)驗(yàn)
1.1分析方法原理和實(shí)驗(yàn)
1.1.1氫氧化物的測(cè)定
堿性鍍液碳酸鹽積累是不可避免的,碳酸鹽也是堿性物質(zhì),干擾氫氧化物的測(cè)定,用氯化鋇將碳酸鹽沉淀出來,避免了干擾。
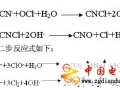
Na2CO3+BaCl2=BaCO3↓+2NaCl(1)
氯化鈣也能使碳酸鹽沉淀:
Na2CO3+CaCl2=CaCO3↓+2NaCl(2)
但氯化鈣遇到氫氧化物會(huì)產(chǎn)生氫氧化鈣沉淀:
2NaOH+CaCl2=Ca(OH)2↓+2NaCl(3)
碳酸鈣和碳酸鋇沉淀,兩者溶度積相同,在離子強(qiáng)度為0.1的溶液中都是3.0×10-8[3]。用氯化鈣來消除碳酸鹽的干擾是可行的,然而,氫氧化鋇是可溶物質(zhì),氫氧化鈣溶解度較小,其溶度積Ksp=1.3×10-5[3],是否影響分析的正常進(jìn)行是研究實(shí)驗(yàn)的關(guān)鍵。
測(cè)定時(shí)加入100g/L氯化鈣溶液10mL,錐形瓶中c(氯化鈣)為0.09mol/L。
即在錐形瓶的100mL溶液中氫氧化鈉在0.05g以內(nèi)就不會(huì)產(chǎn)生氫氧化鈣沉淀。折合ρ(氫氧化鈉)=50g/L的鍍液可以取樣1mL。實(shí)踐證明,即使離子濃度超過了溶度積,也不會(huì)瞬間沉淀完全。而且新生成的氫氧化鈣顆粒極細(xì),同樣與鹽酸標(biāo)準(zhǔn)溶液發(fā)生反應(yīng),并不影響測(cè)定。