陶冶,張永君
(華南理工大學機械與汽車工程學院,廣東廣州510640)
摘要:在醫(yī)用鎂合金功能化表面改性技術中,仿生鈍化具有其他方法無可比擬的優(yōu)越性。利用仿生鈍化技術,可在鎂合金表面原位制備兼具優(yōu)異生物相容性、生物活性和降解控制功能的生物磷灰石膜層,全面滿足鎂合金生物醫(yī)用對表面質量的苛刻要求。本文分別從前處理、鈍化工藝、鈍化后處理等方面,綜述了醫(yī)用鎂合金仿生鈍化技術的研究進展,并展望了醫(yī)用鎂合金仿生鈍化技術的發(fā)展趨勢。
關鍵詞:醫(yī)用鎂合金;仿生鈍化;羥基磷灰石
中圖分類號:R318.08; TG178 文獻標志碼:A
文章編號:1004 - 227X (2012) 03 - 0039 - 04
1前言
與投入臨床使用的各種金屬植入材料相比,鎂合金作為硬組織植入材料具有以下突出的優(yōu)點[1-2]:優(yōu)異的生物相容性、力學相容性和生物可降解性;密度與人體骨骼接近;比強度和比剛度高,可有效減小應力遮擋效應。但鎂合金的耐蝕性較差,尤其在含Cl-離子的腐蝕介質中,其表面氧化膜會被破壞,導致腐蝕加劇[3]。因此,鎂合金的表面改性處理對于鎂合金的生物醫(yī)用具有重要意義。羥基磷灰石[HA,Ca10(P04)6(OH)2)]具有良好的化學穩(wěn)定性和生物相容性,植入人體后與骨組織有較好的結合力[4]。但純HA強度低、脆性大及抗疲勞性差等缺陷限制了其承重應用[5]。因此,在鎂合金表面制備具有生物活性的HA涂層,可集成鎂合金
的強度韌性和HA的耐蝕及生物相容性,得到滿足臨床應用的人體硬組織修復替代材料。
目前,醫(yī)用金屬材料表面制備生物涂層的方法很多,主要有:仿生鈍化[6-8]、微弧氧化[9]、電化學沉積[10]、等離子噴涂[11]、離子束輔助沉積[12]、溶膠一凝膠[13]等。與其他方法相比,仿生鈍化法具有低溫操作、工藝簡單、生物相容性好[14]等優(yōu)點,因此,越來越受關注。仿生鈍化是模擬自然界中HA的礦化過程,在自然溫和的條件下于模擬體液(SBF)中自發(fā)沉積生物活性HA的方法[15]。該法首先使基片表面帶上功能性基團,再浸入無機礦物溶液中使無機物在功能化表面上異相成核并受控生長[16]。其中,基片表面的預處理和浸泡溶液的成分對涂層生成的影響最為關鍵,這是因為預處理的效果直接決定了基片材料的表面異相形核能力;
而浸泡溶液的pH、成分及濃度等直接影響磷灰石涂層的成分、結晶度和生長速率等[17]。
2前處理工藝
2.1堿及堿熱處理法
金屬浸入堿溶液時,表面會形成水合凝膠層,該凝膠層包含許多不穩(wěn)定的水和水合離子,經熱處理可誘導形核。一旦形核,可吸收周圍離子形成涂層[18]。
X.N. Xu等[19]將鈣含量為1.4%的鈣鎂合金,分別用Na2HP04、Na2C03、NaHC03處理24 h,再在空氣氣氛中500 ℃處理12 h,最后將所有試樣超聲清洗并放入SBF溶液中測試。結果表明,3種試樣的腐蝕速率順序為:NaHC03< Na2HP04< Na2C03。L.L.Tan等[20]先將AZ31鎂合金用酒精浸泡10 min,再置于弱堿性的Na2HP04溶液中60 ℃處理,最后置于NaH2P04·12H20
和Ca(N03)2的混合溶液中70 ℃下浸泡48 h,得到性能良好的鈣磷涂層。
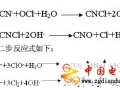
2.2酸堿二步處理法
龔沛[21]將純鎂置于1 moI/L HCI溶液中處理3 min后,再用0.5 mol/L NaOH溶液100 ℃處理30 min,隨后將試樣進行預鈣化處理,最后放入SBF中沉積。結果表明,酸堿處理后,純鎂表面變得粗糙多孔,同時多孔的表面有大量金屬氧化物生成,有利于磷灰石的形成。
L.P.Xu等[22]先將Mg-Mn-Zn合金浸入63 ℃的堿溶液中處理15 min,再用磷酸和硫酸的混合溶液活化5~10 s,最后將Mg-Mn-Zn合金放入磷化溶液中浸泡6 min,在表面獲得一層具有生物活性的鈣磷涂層。
2.3預鈣化法
該法通過在金屬基體表面引入大量的Ca2+來加快磷酸鈣晶核在表面的生長,從而縮短HA涂層的生長周期。J.Hu等[23]以A291D鎂合金為基體,先將試樣放入0.17 mol/L Ca(N03)2溶液中,隨后向Ca(N03)2溶液中滴加等量的0.1 moI/L K2HP04溶液,滴加完后將試樣置于混合液中浸泡3h,最后將預鈣化的試樣放入37 ℃的SBF溶液中分別浸泡不同時間,每24 h更換一次SBF溶液。結果表明,經預鈣化處理的AZ91D表面生成一層磷酸氫鈣水合物,該水合物不僅能在SBF溶液中轉化為HA,還可誘導HA在鎂合金表面沉積。
2.4 其他方法
G.Y.Liu等[24]先用微弧氧化(MAO)法在高純鎂表面得到MAO涂層,再放入27 0C的、由磁力攪拌的Ca(N03)2和K2HP04混合溶液中浸泡3h,隨后靜置2h,得到HA和二水磷酸氫鈣的混合涂層,此涂層表現出相當好的生物活性。郭潔等[25]的研究表明,經有機物熱處理后,AZ91D鎂合金在SBF及飽和鈣磷溶液(CP)中時,HA的沉積速率和結晶度都優(yōu)于堿熱法處理。
3鈍化工藝
仿生鈍化生成HA涂層的原理及工藝雖然比較簡單,但影響因素復雜。目前主要在鈍化液成分、處理時間以及反應溫度等方面控制涂層的生長。
3.1鈍化液的pH
S.Hiromoto等[26]研究了pH對純鎂表面HA結晶度的影響。鈍化液由濃度均為0.05 moUL的Ca-EDTA
和K2HP04組成,用聚四氟乙烯容器裝盛,鈍化的工藝條件為95 ℃、8h,用1 mol/L NaOH溶液調節(jié)pH至5.4、6.3、7.3、11.3。結果表明,隨著pH的升高,HA涂層的結晶度也相應增大。
3.2鈍化液的成分
目前較常用的鈍化液為SBF溶液,該溶液中各種離子的濃度與人體血漿中的離子濃度相近,但其配制必須按照一定的順序,否則將會產生沉淀[27]。由于仿生鈍化的目的是得到性能良好的HA涂層,為縮短制備時間及提高涂層性能,用于浸泡的模擬體液可與人體體液有較大的區(qū)別。表1為SBF、改性模擬體液(M-SBF)、CP 3種不同模擬體液的組成[27-29]。

C.Lorenz等[28]先將純鎂放入1mol/L NaOH中處理24h,隨后放入M-SBF中浸泡5d最后進行細胞培養(yǎng)實驗。結果表明,在M.SBF中浸泡后純鎂表面生成一層粗糙的具有生物活性的無定形Ca/Mg 磷酸鹽涂層,經堿處理的純鎂能使細胞很好地附著在其表面龔沛等[29]將預處理過的純鎂放入CP中,發(fā)現浸泡6d后即可在純鎂基體表面制備均勻的HA涂層。
向鈍化液中加入其他成分的離子,可生成含有該種成分的鈣磷涂層,從而提高鈣磷涂層的性能S.S. Singh等[30]先用3%的硝酸與酒精的混合混合溶液對AZ31鎂合金進行酸洗,隨后在65 ℃的50 g/L NaOH溶液中浸泡1h并60 ℃烘干,再置于鈍化液中于37℃下鈍化2h,最后60℃下烘干得到含Ca、P、Si的涂層。細胞實驗表明,含有硅酸鹽的鈣磷涂層使單純鈣磷涂層的生物相容性提高。鈍化液組成為:CaCl2 3mmol/L,硅酸鹽O、0.3和0.6 mmol/L,NH2P04 1.8、1.5和1.2mmol/L,n(Ca)/n(P+Si)恒為1.67。
另外,R.Štulajterová等[31]發(fā)現增大溶液中鈣離子的濃度,可加快磷酸氫鈣(DCPD)轉化為所羧基磷灰石的速率。 I
3.3處理時間及反應溫度
M. Tomozawa等[32]研究了沉積時間對涂層耐蝕性的影響。首先用體積分數為8%的硝酸和1%的硫酸混合溶液對高純鎂進行拋光,然后在90 ℃下鈍化處理10~480 min,鈍化液由濃度均為0.25 mol/L的Ca-EDTA和KH2P04組成。結果表明,涂層的厚度隨處理時間的延長而增大,耐蝕性也隨之提高。文獻[33]采用相同成分的鈍化液,研究了Ca-EDTA濃度[n(Ca)/n(P+Si)
恒為1:1和溶液溫度對涂層的影響。結果表明,高于60 ℃下處理所得涂層為HA,且Ca_EDTA濃度為0.25 mol/L時,在90 ℃下處理2h可得到均勻、致密且結晶度高的HA涂層。
4后處理工藝
有時仿生鈍化處理所得涂層成分為HA的前驅體,因此要通過后處理將其完全轉化為HA涂層。X.B.Chen等[34]先將高純鎂放入濃度均為0.01 mol/L的Ca(N03)2·4H20和Na3P04組成的混合溶液中65 ℃處理2 min,再在80 ℃下用10 g/L NaOH溶液浸泡60 min,在純鎂表面得到HA-Mg(OH)2涂層。另外,他們還通過軟件計算出65 ℃下Ca2+和pH對涂層成分影響的熱力學圖解。
5發(fā)展趨勢及展望
某些仿生鈍化前處理方法存在一定的缺陷,如酸蝕會對醫(yī)用鎂合金的力學性能造成一定的破壞,這對人體硬組織植入材料來說十分不利。另外,不同的前處理對涂層沉積的影響也十分明顯。因此,前處理的研究仍是一個重要的方向。
單純使用仿生鈍化法制得的生物涂層與合金之間的結合強度較低,且生長周期較慢。目前有些方法如電化學法,可快速制得HA涂層,且涂層的結合強度也有所提高。因此,可考慮將仿生法作為前處理,結合其他生物涂層制備方法,從而得到結合強度高且生物活性好的涂層。
參考文獻:略