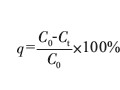【簡介】
(中南大學冶金科學與工程學院,湖南長沙410083)
摘要:幾乎所有的鍍鎳溶液都用硼酸作緩沖劑,但含硼化合物毒性高。研制了一種適合于電沉積鎳的新型電鍍溶液,鍍液中檸檬酸鈉充當緩沖劑和絡合劑,這種鍍液的緩沖容量比傳統(tǒng)Watts大。研究了檸檬酸鈉對陰極極化曲線、陰極電流效率、鍍液分散因子的影響。用掃描電鏡檢查:鎳沉積層致密、針孔少、結晶細小,X射線分析結果表明,與從Watts鍍液中得到的鎳沉積層比,從檸檬酸鈉鍍液中得到的鎳沉積層晶粒小,晶面取向隨機。因此,在Watts電鍍液中,檸檬酸鈉是硼酸的有效替代品。
關鍵詞:電沉積鎳;檸檬酸鹽鍍液;分散因子;緩沖容量
中圖分類號:TM911.14;TQ153.12 文獻標識碼:A
文章編號:1001-9731(2010)05-0903-04
1引言
鎳及鎳基合金具有優(yōu)良的機械加工和防腐性能,因此,常通過電沉積鎳及鎳基合金的方法制備合適的裝飾和功能性金屬鍍層,用于延長工業(yè)、交通和服務設施的壽命,以及用作唱針、電鑄印刷板、金屬箔、管、薄膜和其它用品。
電鍍溶液的選擇主要取決于所需鍍層的性質和要求。氨基磺酸鹽溶液是一種重要的鍍鎳體系,從該鍍液中沉積的鎳層具有低內應力和優(yōu)異的機械性能,但氨基磺酸鹽鎳價格高,從經濟成本角度考慮,所得鍍層昂貴。Watts鍍液是應用最廣的鍍鎳溶液,它主要包括硫酸鎳、氯化鎳、硼酸和有機光亮劑等。在氨基磺酸鹽和Watts鍍液中,硼酸是必不可少的緩沖試劑,但含硼化合物的毒性高。含硼廢渣廢水排放,使地下水及江河水質受到嚴重污染,嚴重影響生態(tài)平衡和人類健康。為了減少和消除硼毒的危害,1993年、1998年世界衛(wèi)生組織先后規(guī)定飲用水中的含硼量應低于0.3、0.5mg/L,世界上許多國家也相繼制定了飲用水含硼標準,我國也于2002年修訂地面水環(huán)境質量標準時,首次將硼元素列入“集中式生活飲用水地表水源地特定項目”的80個指標中,規(guī)定硼的標準限值為0.5mg/L。
硼常常因巖石風化、海水蒸發(fā)、火山運動等自然因素進入環(huán)境中,也有許多人為因素引起環(huán)境中含硼量增高,鍍鎳工業(yè)廢水排放就是加重水資源硼污染的重要因素之一。因此,在鍍鎳工業(yè)上,尋找一種對環(huán)境更友好的硼酸替代品是非常必要的,這對降低廢水處理成本、保護環(huán)境和促進鍍鎳工業(yè)的可持續(xù)發(fā)展大有裨益。
本文研制了一種新的鍍鎳溶液:就是用檸檬酸鈉取代硼酸作鍍液的緩沖劑,檸檬酸鈉可用于食品工業(yè),對人體健康、對環(huán)境友好,而且價格便宜。比較了檸檬酸鈉與硼酸鍍液的緩沖容量和分散因子,研究了檸檬酸鈉濃度對鍍液緩沖容量和分散能力、陰極電流效率、陰極極化曲線的影響。用掃描電鏡檢查鎳沉積層的表面形貌,X射線衍射分析晶體結構。
2實驗
2.1電鍍溶液
鍍鎳溶液主要包括硫酸鎳、氯化鎳、檸檬酸鈉、十二烷基硫酸鈉,鍍液的化學成分見表1,所有鍍液都由新制備的去離子水和分析純化學試劑配制,鍍液的pH值用稀硫酸和氫氧化鈉調整。

2.2實驗過程
陽極用電解鎳(
鍍液的分散因子用Haring-Blum槽測定。
鍍液滴定曲線和緩沖容量的測量:取樣100mL用1.0085mol/L標準氫氧化鈉溶液滴定,在滴定過程中,不斷攪拌溶液,待溶液清亮后再用pHS-25型酸度計測量pH值,以確定滴定曲線,計算出在一定緩沖范圍內鍍液的緩沖容量。
陰極極化曲線在CHI
3結果和討論
3.1pH滴定曲線和緩沖容量緩沖容量是衡量緩沖能力大小的尺度,通過滴定分析確定。
圖1是pH滴定曲線圖,圖中曲線1表示不含緩沖劑的鍍液滴定曲線,結果表明基本沒有緩沖容量。在上述鍍液中加入硼酸,鍍液的緩沖容量有所增加(曲線2)。另一方面,檸檬酸鹽鍍液顯示了較強的pH緩沖能力(曲線3),特別是在pH值<3時;而在pH值為3~5之間,鍍液的緩沖能力顯著降低,根據pH滴定曲線和VanSlyke方程,計算出緩沖容量見表2。

從圖1曲線和表2計算結果說明,對于電沉積鎳體系,沒有緩沖劑的鍍液,pH值變化很快,鍍液不穩(wěn)定,容易形成Ni(OH)2沉淀;相比于硼酸作緩沖劑的溶液,檸檬酸鈉溶液緩沖容量更大,緩沖能力更強。不同檸檬酸鈉含量的鍍鎳溶液pH滴定曲線和pH在3~5范圍內的緩沖容量分別見圖2和3。從圖3可以看出,隨著檸檬酸鈉濃度提高,緩沖容量幾乎線性增大,溶液的緩沖能力顯著提高。

觀察pH滴定曲線,在檸檬酸鹽鍍液中存在有自由的檸檬酸(沒有與鎳離子形成絡合物)和[Ni(HCit)]絡合物,它們都能提供H+離子以中和NaOH溶液中的OH-離子,因此,檸檬酸鹽鍍液的緩沖能力增強。在pH緩沖容量顯著減小的溶液pH范圍,[Ni(Cit)]-絡合物占支配地位,檸檬酸中的所有3個H+離子都發(fā)生電離,此時溶液的pH緩沖容量基本喪失。綜上所述,檸檬酸鈉用作鍍鎳溶液的緩沖劑,其緩沖容量比硼酸大,鍍液不需頻繁調整也能得到質量穩(wěn)定的鍍層,并且對環(huán)境友好。
3.2分散能力
用分散因子(TI)[9]來表征鍍液的分散能力優(yōu)點是簡單、精度高。圖4是Watts鍍液和檸檬酸鈉鍍液的金屬分布比(M)與線性比(K)之間的關系,從圖可以看出M與K之間有很好的線性關系,并且通過M=1、K=1這個代表性的點。

分別求出檸檬酸鈉鍍液和硼酸鍍液的分散因子分別為0.861和0.783,二者相差不大,證明這兩種鍍液的分散能力相當。
3.3陰極電流效率
測定了在pH為4、溫度
在pH值為2.0~5.5范圍內,研究了pH值對陰極電流效率的影響,如圖5。很清楚,當pH在2~4范圍內變化,鎳沉積的電流效率隨pH值的增加而增加,當pH>4后,電流效率有所下降,在pH=4時,電流效率達到98%。這種變化意味著當鍍液的pH值下降,氫氣析出反應更容易發(fā)生,從而降低了陰極電流效率,這與后面要討論的pH下降引起陰極極化曲線向負得少的方向變化是一致的,因為pH值減小能降低氫析出反應的過電位。因此溶液的pH值在3~5之間是適宜的。

保持鍍液中硫酸鎳濃度不變,發(fā)現(xiàn)陰極電流效率隨著檸檬酸根離子的增加而下降(見圖6),這個結果證明:檸檬酸根離子濃度增大,鎳的絡合物增加,自由Ni2+離子濃度降低,析氫副反應加劇。因此,溶液中Ni2+離子濃度與檸檬酸根離子濃度之比(即[Ni2+/[Cit3-])不宜過低。

3.4陰極極化曲線
硼酸和檸檬酸鈉對在低碳鋼帶上沉積鎳的陰極極化的影響如圖7,曲線1表示硫酸鎳、氯化鎳鍍液中的陰極極化,很明顯,只有較小的極化電位;加入硼酸到上述鍍液中,極化曲線向電位負方向稍有增大(曲線2),硼酸的影響主要是阻擋了鎳沉積的活性位置;在上述溶液中加入檸檬酸鈉,陰極極化明顯加大(曲線3),這種現(xiàn)象是由于檸檬酸根與鎳離子形成了可溶性絡合物,降低了自由的Ni2+濃度,另外,檸檬酸根離子本身或以金屬絡合物形式吸附在陰極表面,阻礙Ni2+發(fā)生放電的活性點。

從表3鎳-檸檬酸鹽絡合物的穩(wěn)定常數值可以推出,在溶液中NiCit-是主要的絡合物,它的平衡常數值最大,另外,由于檸檬酸鈉的濃度低于金屬離子濃度,因此在給定的pH條件下,自由的Ni2+濃度也高。

隨著檸檬酸根鹽濃度加大,更多的Ni2+離子形成絡合物,自由Ni2+濃度進一步降低;同時更多的檸檬酸根離子吸附在陰極表面,妨礙Ni2+離子放電,因此,陰極極化會隨著檸檬酸鹽濃度的加大而增加,在低電流密度區(qū)更明顯,如圖8。
3.5沉積層的表面形貌和結構
通過掃描電鏡檢查,從檸檬酸鹽鍍液中沉積的鎳均勻分布在陰極鋼帶上,形狀類似“卷心菜”(見圖9),結晶顆粒比從Watts鍍液中沉積的鎳細,因此可推斷出:檸檬酸鹽鍍液中配合物的存在能幫助產生結晶更細小的沉積層。

圖10是分別從檸檬酸鹽和Watts鍍液中沉積鎳的XRD圖,表明從檸檬酸鹽鍍液中得到的是面心立方結構鎳,二者的特征譜線與純鎳一致。但由于鍍層只有6μm,不足以阻止X射線通過鎳層而顯示出基體鐵的譜線。

4結論
(1)對于鎳沉積,與Watts鍍液相比,檸檬酸鈉鍍液具有更高的緩沖容量、相近的分散因子和陰極電流效率,它是一種實用、有效、對環(huán)境更友好的硼酸的替代品。
(2)檸檬酸鹽鍍液的緩沖容量和陰極電流效率與檸檬酸鈉濃度密切相關。檸檬酸鈉濃度增大,緩沖容量線性提高,而陰極電流效率降低。
(3)從檸檬酸鹽鍍液中制備的鎳沉積層致密、針孔少,晶粒細,呈“卷心菜”形狀和面心立方結構。
參考文獻:
[1]Supicova M,Roik R,TrnkovaL,et al.[J].J Solid State Electrochem,2006,10:61-68. [2]Supicova M,Rozik R,TrnkovaL,et al.[J].J Solid State Electrochem,2006,10:61-68.
[3]Stetten D.[J].Anal Chem,1951,23(8):1177-1179.
[4]吳萬偉,田宏建.[J].北京師范大學學報(自然科學版),1989,2:50-53.
[5]王宏英.[J].表面技術,1994,23(4):176-179.
[6]Chadi Y,Wolfram K,Roger C,et al.[J].Environmental Geochemistry and Health,2005,27:419-427.
[7]GB3838-2002,地表水環(huán)境質量標準.
[8]Van Slyke D D.[J].J Bio Chem,1922,52:525-570.
[9]Robert V,Jelinek,Hero F.[J].Journal of the Electro-chemical Society,1957,104(5):279-281.[10]Rashwan S M.[J].Metall,1999,53(12):686-691.