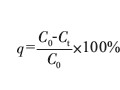【簡介】
0 前言
貧鈾因其獨(dú)特的性能而在核工業(yè)上具有廣泛的用途,但其化學(xué)性質(zhì)十分活潑,很容易在大氣環(huán)境中尤其是在沿海及工業(yè)地區(qū)被腐蝕。為了減緩鈾的腐蝕,同時(shí)防止放射性污染,防腐蝕鍍層受到了人們的極大關(guān)注。在眾多防腐蝕鍍層中,電鍍鎳的研究較早而且應(yīng)用最廣泛。普通直流電鍍層由于孔隙明顯而直接
影響到鍍層對鈾基體的防腐蝕性能。脈沖電鍍能有效地細(xì)化鍍層晶粒、改善鍍層的致密性,但貧鈾表面脈沖電鍍鎳的電化學(xué)腐蝕行為研究尚未見公開報(bào)道。
本工作在氨基磺酸鎳鍍液中采用脈沖電鍍方法在貧鈾表面制備鎳鍍層,與直流電鍍鎳比較,采用線性極化、動電位極化、電化學(xué)阻抗技術(shù)對貧鈾表面脈沖電鍍鎳的電化學(xué)腐蝕行為進(jìn)行研究。
1 試驗(yàn)
1.1 樣品制備
貧鈾在電鍍前依次經(jīng)金相砂紙逐級打磨至900號,然后進(jìn)行除油、1:1硝酸清洗、蒸餾水洗。分別采用t3產(chǎn)HCP.2510脈沖電鍍電源和直流電鍍電源進(jìn)行電鍍。鍍液組成及工藝條件:450g/L氨基磺酸鎳,35g/L硼酸,7g/L氯化鎳,10mL/L添加劑,所用試劑均為分析純;鍍液溫度為(50±1)℃,鍍液采用空氣攪拌,pH值為4.2,陽極為含硫活性鎳陽極,陰極為金屬鈾;脈沖電鍍的導(dǎo)通時(shí)間為0.5ms,間歇時(shí)間為5ms,平均電流密度為1A/dm,直流電鍍的電流密度為1A/dm,電鍍時(shí)間均為0.5h,鍍層厚度約為6.5m。
1.2 測試方法
采用PARSTAT2263DC+AC電化學(xué)綜合測試儀及PowerCorr、Powersine軟件進(jìn)行電化學(xué)腐蝕測試。試驗(yàn)中,樣品為工作電極,飽和甘汞電極為參比電極,高純石墨棒為輔助電極,測試面積為1em。腐蝕介質(zhì)為含50g/gC1一的氯化鉀溶液,溫度為室溫。線性極化的電位掃描范圍為一10~10mV(相對腐蝕電位),掃描速度為0.167mV/s,采用軟件中的線性擬合方法自動求解腐蝕體系的極化電阻R和腐蝕電流;動電位極化的電位掃描范圍為一50~800mV(相對腐蝕電位),掃描速度為2mV/s。電化學(xué)阻抗譜的測量頻率范圍為1.0×10~~1.0×10Hz,擾動信號為幅值±5mV的正弦波交流信號。
2 結(jié)果與討論
2.1 線性極化電阻
采用線性極化法測定鈾表面脈沖電鍍鎳、直流電鍍鎳、金屬鈾及金屬鎳樣品的線性極化曲線,用Power-Corr軟件中極化電阻擬合對線性極化曲線進(jìn)行擬合,其結(jié)果見表1。表中腐蝕電位為線性極化前電極的開路電位。從腐蝕電位看,鈾表面直流電鍍鎳樣品的腐蝕電位明顯高于裸體鈾基體的腐蝕電位,而脈沖電鍍鎳樣品的腐蝕電位又比直流電鍍鎳樣品高,且與金屬鎳的腐蝕電位接近。這表明鈾表面鎳鍍層存在一定的孔隙,在50g/gC1一電解質(zhì)溶液中鎳鍍層與鈾基體形成了腐蝕電偶對,所測得的腐蝕電位即電偶電位介于金屬鎳和金屬鈾之間,脈沖電鍍鎳腐蝕電位高于直流電鍍鎳。根據(jù)Mansfeld¨電偶腐蝕中的面積關(guān)系可知,脈沖電鍍層的致密性優(yōu)于直流鍍層,從而對鈾基體具有更好的防腐蝕性能。

從極化電阻擬合結(jié)果看,裸體鈾的極化電阻最小,其電極過程阻力最小,電極反應(yīng)最容易進(jìn)行,因而它最容易腐蝕,腐蝕電流最大;鈾表面電鍍鎳鍍層后,其極化電阻呈數(shù)量級增加,腐蝕電流急劇下降,這說明鎳鍍層對鈾基體的保護(hù)是有效的。從表中數(shù)據(jù)可以看出,脈沖電鍍鎳的極化電阻大于直流電鍍鎳的極化電阻,其腐蝕電流小于直流電鍍鎳。這主要是由于脈沖電鍍鎳較細(xì)的晶粒有效地降低了鍍層的孔隙率、提高了鍍層的致密性,從而改善了對鈾基體的防腐蝕性能。
2.2 動電位極化曲線
采用動電位極化技術(shù)可以研究電極在較大極化范圍內(nèi)的極化特性,由于電極電位的變化,電極表面雙電層特性也在不斷地變化,從而直接導(dǎo)致電極過程動力學(xué)的變化。鈾表面脈沖電鍍鎳、直流電鍍鎳、金屬鈾及金屬鎳樣品的動電位極化曲線見圖1。由圖1可以看出,鈾表面脈沖電鍍鎳與直流電鍍鎳和金屬鎳都具有類似的極化特性。在腐蝕電位附近,極化電流隨極化過電位的增大而快速增加,表明電極過程受電子轉(zhuǎn)移的電化學(xué)活化控制。當(dāng)陽極極化到弱極化區(qū)后,極化電流隨極化電位的升高而增大,但極化曲線的斜率愈來愈大,即電極過程的阻力越來越大,鎳鍍層出現(xiàn)了“偽鈍化”現(xiàn)象],電子在電子導(dǎo)體(鍍鎳鈾電極)與離子導(dǎo)體(50g/gCI一水溶液)之間的轉(zhuǎn)移越來越困難。當(dāng)極化電位進(jìn)一步升高,極化曲線出現(xiàn)轉(zhuǎn)折點(diǎn)。在轉(zhuǎn)折點(diǎn)以上附近極化電流迅速增加,說明鎳鍍層出現(xiàn)了點(diǎn)蝕,局部活性點(diǎn)構(gòu)成了大陰極小陽極的腐蝕原電池,從而加速了樣品的腐蝕。

與直流電鍍鎳相比,鈾表面脈沖電鍍鎳與金屬鎳的極化特性更為接近,這說明脈沖電鍍鎳具有低的孔隙率。從圖1可以看出,在相同極化電位下,直流電鍍鎳的極化電流明顯大于金屬鎳。這主要是由于直流電鍍鎳存在較多孔隙,鍍層與鈾基體之間形成了局部電偶腐蝕而使得腐蝕加劇。
從圖1還可看出,金屬鈾的腐蝕電位遠(yuǎn)低于鎳和鎳鍍層的腐蝕電位,在整個(gè)極化范圍內(nèi)極化電流都隨極化電位的升高而增大,沒有出現(xiàn)“偽鈍化”區(qū)。這表明金屬鈾在整個(gè)極化范圍內(nèi),電極過程都受電化學(xué)活化控制,耐腐蝕性能較差。
由腐蝕電位可得,在含50g/gC1一的電解質(zhì)溶液中,金屬鎳的腐蝕電位高于金屬鈾的腐蝕電位,鎳鍍層相對鈾基體是陰極性鍍層,它對金屬鈾的保護(hù)完全基于完整致密鍍層對腐蝕介質(zhì)的物理屏障作用,不完整的鍍層會在電解質(zhì)的作用下通過鍍層孔隙與鈾基體形成腐蝕電偶對,鈾基體作為腐蝕電偶對的陽極而被加速腐蝕,要改善鍍層對鈾基體的防腐蝕能力就要提高鍍層的完整性和致密性。
2.3 電化學(xué)阻抗譜
鈾表面脈沖電鍍鎳、直流電鍍鎳、金屬鈾及金屬鎳樣品的電化學(xué)阻抗復(fù)平面圖(Nyquist)見圖2。從圖2可以看出,鍍層樣品的電化學(xué)阻抗復(fù)平面圖都呈現(xiàn)出明顯的容抗弧特性,在Nyquist圖的左端,各電化學(xué)阻抗譜非常接近。這說明在高頻段,兩種鍍層的阻抗特性較為相似。這是由于在高頻段,電極過程主要取決于鍍層表面雙電層電容的充放電效應(yīng)。

從圖2可以看出,金屬鎳的電化學(xué)阻抗容抗弧最大,其次是脈沖電鍍鎳,再次是直流電鍍鎳,最小是金屬鈾。這表明脈沖電鍍鎳電極過程的電荷轉(zhuǎn)移電阻較直流電鍍鎳大,且與金屬鎳接近,說明脈沖電鍍鎳較直流電鍍鎳完整致密,從而能為金屬鈾提供更佳的保護(hù)作用。
2.4 腐蝕電位隨時(shí)間的變化
鈾表面脈沖電鍍鎳鍍層的腐蝕電位隨時(shí)間的變化特性見圖3。由圖3可以看出,鍍鎳鈾樣品浸泡在含50t~g/gC1一的氯化鉀溶液中1h后,電極的腐蝕電位穩(wěn)定在一150mV(V8SCE)左右。在前36h,鈾表面脈沖電鍍鎳的腐蝕電位雖逐漸降低,但變化較為緩慢。這說明在這期間,鎳鍍層發(fā)生了一定的腐蝕,并存在一些鍍層孔隙的腐蝕擴(kuò)展。在36~72h之間,樣品的腐蝕電位急劇下降,表明隨著腐蝕的深人,鍍層的孔隙已經(jīng)擴(kuò)展到鍍層與鈾基體的界面。在界面處,鎳鍍層與鈾基體之間在電解質(zhì)溶液中發(fā)生電偶腐蝕。隨著腐蝕的擴(kuò)展,腐蝕產(chǎn)物不斷積累,由于腐蝕產(chǎn)物體積的增長導(dǎo)致了鍍層的開裂。在72~96h之間,電極的腐蝕電位逐漸趨于穩(wěn)定,并接近裸體鈾的腐蝕電位。這表明鎳鍍層從開裂轉(zhuǎn)向剝落,基體鈾暴露在電解質(zhì)溶液中的面積越來越大。

2.5 極化電阻與腐蝕電流隨時(shí)間的變化
由線性極化所得的鈾表面脈沖電鍍鎳在含50t~g/gC1一的氯化鉀溶液中極化電阻與腐蝕電流隨時(shí)間的變化見圖4。
由圖4可以看出,隨著鍍鎳鈾樣品浸人電解質(zhì)溶液時(shí)間的延長,極化電阻逐漸下降并趨于穩(wěn)定;而腐蝕電流變化趨勢與極化電阻相反,先是較為穩(wěn)定,后來顯著增加。從鍍鎳鈾樣品的腐蝕過程看,先是在氯離子的作用下,鎳鍍層鈍化膜破裂,極化電阻逐漸下降,腐蝕電流逐漸增大。點(diǎn)蝕出現(xiàn)后,蝕孔內(nèi)發(fā)生自催化作用加速蝕孔的進(jìn)一步腐蝕。雖然腐蝕電流也有所增加,但鎳鍍層尚未被腐蝕穿透,對鈾基體還有較好的保護(hù)作用。在48~60h之間,極化電阻顯著降低,腐蝕電流迅速增大。這表明鎳鍍層在這段時(shí)間內(nèi)已經(jīng)被腐蝕穿透,并出現(xiàn)裂紋。在60h后,樣品的腐蝕電流快速增大,極化電阻也逐漸減小。這主要是由鍍層局部剝落所致,此時(shí)鎳鍍層對鈾基體的腐蝕保護(hù)作用已基本喪失。

2.6 電化學(xué)阻抗譜隨時(shí)間的變化
脈沖電鍍鎳在含50/.Lg/gC1一的氯化鉀溶液中的電化學(xué)阻抗譜隨時(shí)間的變化見圖5。從圖5可以看出,脈沖鍍鎳樣品在氯化鉀溶液中的電化學(xué)阻抗譜呈現(xiàn)容抗弧特性,這是由于在電極表面存在雙電層電容和電極反應(yīng)的電荷轉(zhuǎn)移電阻,它們以并聯(lián)的方式對電極過程發(fā)生作用。隨著樣品浸泡時(shí)間的延長,容抗弧呈明顯收縮趨勢,表明電極過程的電荷轉(zhuǎn)移電阻以及電極反應(yīng)的阻抗幅值明顯減小,鍍層對鈾基體的防腐蝕性能逐漸變差。
低頻端的阻抗幅值可以直接表征鍍層防腐蝕性能的好壞,阻抗幅值越大,鍍層的防腐蝕性能越好。在10mHz時(shí)(圖5中容抗弧右邊的最后一個(gè)點(diǎn))的阻抗幅值見表2。

從表2中的數(shù)據(jù)可以看出,隨著鍍鎳鈾樣品在含5Og/gCI一的氯化鉀溶液中浸泡時(shí)間的延長,電極電化學(xué)阻抗的幅值逐漸降低。在48~72h之間,阻抗幅
值存在突降,這說明電極表面出現(xiàn)了鍍層腐蝕穿透、破裂甚至局部剝落等顯著變化。
脈沖電鍍鎳在含5Og/gCI一的氯化鉀溶液中的Bode相圖隨時(shí)間的變化見圖6。由圖6可以看出,在第1,24,48h測得鍍鎳鈾電極電化學(xué)阻抗相位角僅在低頻段有一個(gè)峰,這表明電極過程具有一個(gè)時(shí)間常數(shù);鍍層完整且未出現(xiàn)腐蝕穿孔、破裂等現(xiàn)象。在48h后,脈沖鍍鎳電極電化學(xué)阻抗相位角出現(xiàn)兩個(gè)峰,分別出現(xiàn)在高頻段和低頻段。這表明電極過程具有兩個(gè)時(shí)間常數(shù);脈沖電鍍鎳已經(jīng)出現(xiàn)腐蝕穿孔、破裂等現(xiàn)象。

3 結(jié)論
在含50μg/gCI一的KCI溶液中,鎳的腐蝕電位高于貧鈾,鎳對貧鈾是一種陰極性鍍層;鈾表面脈沖電鍍鎳致密性比直流電鍍鎳好,對腐蝕介質(zhì)具有更好的物理屏障作用;與直流電鍍鎳相比,鈾表面脈沖電鍍鎳腐蝕電位更高,極化電阻更大,腐蝕電流更小,電化學(xué)阻抗幅值更大,對鈾基體具有更好的防腐蝕性能;隨著時(shí)間的推移,脈沖電鍍鎳腐蝕電位下降,極化電阻減小,腐蝕電流增大,電化學(xué)阻抗幅值降低,電極過程由一個(gè)時(shí)間常數(shù)向兩個(gè)時(shí)間常數(shù)轉(zhuǎn)變;鍍層發(fā)生點(diǎn)蝕后逐漸擴(kuò)展到基體發(fā)生電偶腐蝕,并出現(xiàn)破裂、剝落。