氯鋁酸熔融鹽中電沉積鋁及鋁合金研究的進展
梁成浩, 曹彩紅, 黃乃寶
(大連海事大學交通與物流工程學院,遼寧大連116026)
摘要: 綜述了近年來在無機及有機氯鋁酸熔融鹽中電沉積鋁和鋁合金研究的進展,著重介紹了電沉積金屬及其合金的熔融鹽,電沉積鋁及其合金的無機和有機氯鋁酸熔融鹽,并進行展望。與其他熔融鹽相比,氯鋁酸熔融鹽具有溶解能力強,易于配制,廢液易于處理和價廉等優(yōu)點,在電鍍生產中有著廣闊的應用前景。
關鍵詞: 鋁;鋁合金;氯鋁酸熔融鹽;電沉積
0 前言
100多年來電鍍工業(yè)領域一直采用水溶液作為電鍍液,其優(yōu)點是金屬離子易于溶解,然而由于電化學窗口相對較窄,還原電位很大,導致如:Cr,Zn等金屬電沉積的電流效率下降,基體金屬易發(fā)生氫脆。離子液體作為替代溶劑,在電化學中的應用涉及各個方面,如:電池、光電池、電解、電鍍等領域。在水溶液中很難電沉積的金屬或合金,通常可在熔融鹽中進行電沉積。熔融鹽中由于沒有水,因而可以制備出在水溶液中不能電沉積的單一金屬及各種功能材料。難熔金屬Ti,Al,W的電沉積推動了無水電解液產生。高溫熔融鹽廣泛用于Li,Na,Ti,Al等金屬的電解冶金。上世紀40年代發(fā)現(xiàn)了室溫熔融鹽(也稱為離子液體)。室溫熔融鹽由于不含水,所以不存在水化、水解和析氫等現(xiàn)象,無污染,可循環(huán)使用,是一種很好的綠色溶劑。首先應用于電鍍鋁,之后在無機和有機化學領域相繼開發(fā)得到應用。離子液體作為電沉積金屬的電解質具有以下優(yōu)勢[1]:
(1)離子導電率高(一般在0.1s/m數量級),具有較寬的電化學穩(wěn)定電位窗口(一般3~5V),避免了很多副反應的發(fā)生。
(2)離子液體黏度較大,擴散速率慢,容易獲得納米級的金屬粒子。
(3)具有較寬的液程,從-70~300℃都是較穩(wěn)定的液態(tài)范圍,幾乎沒有蒸氣壓,不揮發(fā)、無色、無味、不燃燒,且與金屬、高分子材料等電化學器件接觸仍保持其性能。
(4)具有高極性,可溶解大量的無機物和有機物,包括一些聚合物和礦物質,溶解性和酸度可調。(5)熔點低,操作溫度在室溫,優(yōu)于高溫熔鹽。易與其他物質分離,可循環(huán)利用。
隨著綠色化學的發(fā)展,許多新的室溫熔融鹽不斷得到開發(fā),日益受到人們關注。本文對常溫可操作的熔融鹽中電沉積鋁及其合金的研究進展進行扼要綜述。
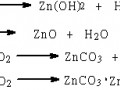
1 電沉積金屬及合金的熔融鹽電沉積金屬所用熔融鹽分為高溫和低溫熔融鹽。常用的高溫熔融鹽體系以堿金屬和堿土金屬的氯化物為主,例如:LiCl-KCl(400~450℃),NaCl-KCl(700~750℃)和LiF-KF(670~750℃),KCl-NaCl-MgCl2(600~650℃)和NaCl-KCl-NaF(700~750℃)。高溫熔融鹽體系主要用于電沉積難熔金屬、稀土金屬及其合金,電解制取超導體膜、半導體膜,以及分離放射性金屬等。電鍍用低溫熔融鹽多以氯鋁酸室溫離子液體為主,進行多種堿金屬(Li,Na)、堿土金屬(Al)和過渡金屬(Fe,Ni,Cu,Ag,Zn,W,Sb等)以及多種金屬合金(Ni-Al,Co-Al,Ga-As,Co-Zn等)的電沉積。此外,金屬Zn,Co,Ti,Ni,Pd,Hg,Sn,Bi,Tl,Pb,Au,Cu等在不同離子液體中的電化學沉積也有相關的報道[2]。不同熔融鹽電沉積的合金,如表1所示。
高溫熔融鹽具有腐蝕設備、耗能、易發(fā)生歧化反應等弊端;低溫熔融鹽不含水,不存在水化、水解、析氫,避免了高溫熔融鹽的弊端,也不像有機溶劑那樣易燃、導電性差。有機溶劑電解質溶解鹽類的能力低,且導電性差;相比而言,低溫熔融鹽作為非水電解質較為理想。
2 氯鋁酸熔融鹽中電沉積鋁及鋁合金氯鋁酸熔融鹽作為電化學溶劑,按照其氯鹽的性質又分為無機和有機兩類,前者是無水AlCl3和無機鹵鹽的熔融鹽,常常含有一種或多種堿金屬的鹵鹽,如:NaCl或NaCl+KCl。氯鋁酸的有機熔融鹽是AlCl3和結構不對稱的有機陽離子的鹵鹽混合在一起制備的,例如:氯化1-丁基吡啶或氯化1,3-烷基咪唑。
2.1 無機氯鋁酸熔融鹽LiQF等[3]研究了金屬鋁在NaAlCl4室溫離子液體中的電沉積,表明隨著電流密度的變化,可得到三種不同類型的鋁:在低電流密度下(小于0.7mA/cm2)得到海綿狀鋁;在中等強度的電流密度下(2~10mA/cm2)得到光滑、致密的電鍍層;而在高電流密度下(大于15mA/cm2)得到樹枝狀的鋁。李景升等[4]在摩爾比為0.66∶0.17∶0.17的AlCl3-NaCl-KCl共融鹽中,在基體鐵上獲得銀白色鋁鍍層。李慶峰等[5]研究了AlCl3-NaCl熔融鹽中鋁的陰極沉積過程,指出在堿性熔體中陰極還原質點為AlCl-4;在酸性熔體中還原質點為Al2Cl-7,Al2Cl-7的還原反應是準可逆的,可能是前置化學步驟或自催化反應。鐵軍等[6]研究了強酸性低熔點電解質熔液中鋁在鎢絲電極上的沉積和溶解損失。沉積鋁的氧化包含有限程度的生成低價鋁離子的反應。金屬鋁的溶解損失由金屬/熔液界面層內的穩(wěn)態(tài)擴散控制。在NaCl-AlCl3熔體中還可以電沉積Al-Nb,Al-Mo,Al-Ta,Al-Ni,Al-Co,Al-Cu,Al-Fe等合金[7-8]。
Stafford等[9]在摩爾比為55∶45的AlCl3-NaCl熔融鹽中得到厚度為10~25μm的Al-Mn合金鍍層。并從摩爾比為2∶1的AlCl3-NaCl的熔鹽體系中,在銅基體和鎢電極上電沉積得到AlTi3合金鍍層[10]。孫淑萍等[11]以NaCl-AlCl3為主鹽,以MnCl2,TiCl3,CeCl4為添加劑,在鋼板和不銹鋼板得到Al-Mn,Al-Mn-Ti,Al-Mn-Ce的合金鍍層。室溫時在離子液體中沉積金屬鈮和鉭的單質較為困難,但是與鋁共沉積合金則可以實現(xiàn)。據文獻報道[12],將Nb3Cl8加入到AlCl3的摩爾分數為55%的AlCl3-NaCl中得到的Nb-Al合金中,Nb的質量分數在18%以上,但這種方法的缺點是Nb3Cl8在電解質中的溶解性較差。然而,采用鈮陽極溶解得到具有電活性的鈮離子,可顯著提高合金中鈮的質量分數,可高達35%以上。
Satfford等[13]進一步研究了鈮在AlCl3的摩爾分數為55%的AlCl3-NaCl中的溶解和Nb-Al合金的電沉積,發(fā)現(xiàn)鈮在1.10V開始氧化,鋁的活性溶解在1.5V開始。雖然鈮可以不斷溶解,但是由于它在熔體中的溶解度太低,且化學穩(wěn)定性差,真正能用于電沉積的電化學活性離子的有效濃度有限。鈮的電沉積反應是由電流密度所決定,而鋁的電沉積反應是由動力學或綜合因素決定的。
2.2 氯鋁酸有機熔融鹽