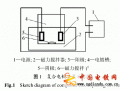
電解蝕刻實(shí)際就是電解某種金屬材料,如電解銅、鐵等。具體做法是將要蝕刻的制件做陽極,用耐蝕金屬材料做輔助陰極。將陽極連接電源的正極,輔助陰極連接電源的負(fù)極。如圖6—7所示。
電解蝕刻實(shí)際就是電解某種金屬材料,如電解銅、鐵等。具體做法是將要蝕刻的制件做陽極,用耐蝕金屬材料做輔助陰極。將陽極連接電源的正極,輔助陰極連接電源的負(fù)極。如圖6—7所示。
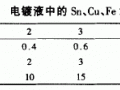
當(dāng)電流通過電極和電解質(zhì)溶液時(shí),在電極的表面及電解質(zhì)溶液中發(fā)生電化學(xué)反應(yīng),利用這種反應(yīng)將要溶解去除的部分金屬去除,達(dá)到金屬腐蝕的目的。根據(jù)法拉第定律,電流的通過量與金屬的溶解量成正比,也就是被蝕刻的金屬越多,消耗的電量就越大。根據(jù)電化學(xué)原理,電解蝕刻裝置的電源接通后,在陽極上發(fā)生氧化反應(yīng)、在輔助陰極上發(fā)生還原反應(yīng)。陽極反應(yīng)的結(jié)果是蝕刻部位的金屬被氧化變成水合離子或絡(luò)合離子進(jìn)入電解質(zhì)溶液。因此,蝕刻部位的金屬不斷地溶解并在金屬的表面留下當(dāng)量電子,其反應(yīng)式
如下:
![]()
式中 M-蝕刻金屬的原子;
ne—溶解金屬留下的當(dāng)量電子數(shù);
M+ne—失去ne個(gè)電子的金屬離子,未水合化;
M+ne.xH20—進(jìn)入電解液的金屬水合離子。
陰極上的反應(yīng)是電解溶液中的還原性物質(zhì)如氫離子、氧分子或金屬正離子等在陰極上得到電子,還原成氫氣析出或生成氫氧根負(fù)離子或金屬沉積物附著在陰極上,因此陰極反應(yīng)是各種還原反應(yīng)的結(jié)果。其電極反應(yīng)如下:2H++2e→H2↑2H20+02+4e→40H-M+ne+ne→M↓