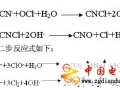
【簡介】
1 陰極上的主反應
電鍍時通入電流,是要在作為陰極的工件上電沉積所需要的鍍層組分,即希望主鹽金屬離子放電還原為金屬原子,最終形成符合要求的電鍍層。故一般僅將主鹽金屬離子的還原反應視為主反應。如鍍鋅是 Zn2++2e- → Zn,鍍銅是Cu2++2e- → Cu,鍍鉻是 Cr2O2-7 + 14H+ + 12e- → 2Cr + 7H20,鍍鎳鐵合金是 Ni2+ + 2e- → Ni及Fe2+ + 2e- → Fe,等等。對帶n個正電荷的金屬離子Men+而言,一般還原反應的通式為:
Men+ + ne- → Me。
事實上,金屬離子并非均以簡單離子的形式存在,因而實際反應要復雜些,如絡離子的破絡、多價金屬離子的分步還原等。主反應是我們希望在陰極上發(fā)生的還原反應。
2 陰極上的副反應
實際在陰極上除了發(fā)生主反應之外,或多或少會發(fā)生一些多數(shù)情況下我們不希望的其他反應,這些統(tǒng)稱為副反應。
2.1 氫離子的還原
氫離子H+還原,最終生成氫氣:
2H++2e- → H2↑。
這是一個最易發(fā)生的主要副反應。多數(shù)情況下該反應都有害:
(1)降低了電源所供電流的利用效率。
(2)氫氣泡附著在工件表面而不能及時逸出時,鍍層會產(chǎn)生氣體針孔、麻點。
(3)由于氫氣分子的體積小,易滲入基體材料,使其產(chǎn)生脆性(專稱為“氫脆”),甚至產(chǎn)生“氫致延遲斷裂”。
(4)滲入基體的氫氣富集時產(chǎn)生很大的壓力,使鍍層在存放一段時間后起小泡。
(5)引起鍍層缺陷,最常見的是高電流密度區(qū)鍍層結(jié)晶粗糙、疏松、燒焦。
(6)裝掛不恰當時,產(chǎn)生的氫氣使工件內(nèi)部局部“窩氣”,無法形成鍍層。