為了保證化學(xué)鍍鎳的質(zhì)量,必須始終保持鍍?cè)〉幕瘜W(xué)成分、工藝技術(shù)參數(shù)在最佳范圍(狀態(tài)),這就要求操作者經(jīng)常進(jìn)行鍍液化學(xué)成分的分析與調(diào)整。
1.Ni2+濃度
鍍液中鎳離子濃度常規(guī)測(cè)定方法是用EDTA絡(luò)合滴定,紫脲酸胺為指示劑。
試劑(1)濃氨水(密度:0。
分析方法:用移液管取出10ml冷卻后的化學(xué)鍍鎳液于250ml的錐形瓶中,并加入100ml蒸餾水、15ml濃氨水、約
式中 M:標(biāo)準(zhǔn)EDTA溶液的摩爾濃度;
V:耗用標(biāo)準(zhǔn)EDTA溶液的毫升數(shù)。
2.還原劑濃度
次亞磷酸鈉NaH2PO2·H2O濃度的測(cè)定
其原理是在酸性條件下,用過量的碘氧化次磷酸鈉,然后用硫代硫酸鈉溶液反滴定自剩余的碘,淀粉為指示劑。
試劑
(1)鹽酸1:1。
(2)碘標(biāo)準(zhǔn)溶液0.1mol按常規(guī)標(biāo)定。
(3)淀粉指示劑1%。
(4)硫代硫酸鈉0.1mol按常規(guī)標(biāo)定。
分析方法:
用移液管量取冷卻后的鍍液5ml于帶蓋的250mL錐形瓶中;加入鹽酸25mL碘標(biāo)準(zhǔn)溶液于此錐形瓶中,加蓋,置于暗處0.5h(溫度不得低于
計(jì)算:
C NaH2PO2·H2O=10.6(
式中M1:標(biāo)準(zhǔn)碘溶液的摩爾濃度;V1:標(biāo)準(zhǔn)碘溶液毫升數(shù);
M2:標(biāo)準(zhǔn)硫代硫酸鈉溶液的摩爾濃度;V2:耗用標(biāo)準(zhǔn)硫代硫酸鈉溶液毫升數(shù)。
3.NaHPO3·5H2O的濃度
化學(xué)鍍鎳浴還原劑反應(yīng)產(chǎn)物中影響最大的是次磷酸鈉的反應(yīng)產(chǎn)物亞磷酸鈉。其他種類的還原劑的反應(yīng)產(chǎn)物的影響較小甚至幾乎無影響,如DMAB。其測(cè)定原理是在堿性條件下,用過量的碘氧化亞磷酸,但次磷酸不參加反應(yīng);然而,用硫代硫酸鈉反滴定剩余的碘;淀粉為指示劑。
試劑
(1)碳酸氫鈉溶液5%。
(2)醋酸98%。
(3)其余試劑同前。
分析方法:
用移液管量取冷卻后的鍍液5ml于250mL的錐形瓶中(可視Na2HPO3含量多少?zèng)Q定吸取鍍液體積),加入蒸鎦水40ml。加入碳酸氫鈉溶液50ml,使用移液管量取40ml標(biāo)準(zhǔn)碘溶液于錐形瓶中,加蓋,放置暗處1h。開啟瓶蓋,滴加醋酸至pH<4,搖勻,用硫代硫酸鈉滴定至溶液呈淡黃色,加入淀粉試劑1ml,繼續(xù)滴定至藍(lán)色消失1min即為終點(diǎn)。
計(jì)算:CNa2HPO3=12.6(
式中M1:標(biāo)準(zhǔn)碘溶液的摩爾濃度;V1:耗用標(biāo)準(zhǔn)碘溶液的毫升數(shù);
M2:標(biāo)準(zhǔn)硫代硫酸鈉溶液的摩爾深度;V2:耗用標(biāo)準(zhǔn)硫代硫酸鈉的毫升數(shù)。
4.其他化學(xué)成分的濃度
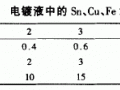
化學(xué)鍍鎳浴中還含有多種有機(jī)羧酸鹽作為絡(luò)合劑、緩沖劑、穩(wěn)定劑等,其深度的測(cè)定在現(xiàn)場(chǎng)進(jìn)行比較困難;大多數(shù)實(shí)驗(yàn)室采用高效液相色譜分離,紅外、紫外可見光譜、質(zhì)譜定性定量分析。化學(xué)鍍鎳浴中有害金屬離子則采用發(fā)射光譜、原子吸收光譜定性定量分析。
5.化學(xué)鍍鎳浴穩(wěn)定性的測(cè)定
取試驗(yàn)化學(xué)鍍鎳液50mL,盛于100mL的試管中,浸入已經(jīng)恒溫至60±
這是一種測(cè)定化學(xué)鍍鎳浴穩(wěn)定性的加速試驗(yàn)方法,可作為鑒別不同化學(xué)鍍鎳浴穩(wěn)定性時(shí)的參考;亦可用于化學(xué)鍍鎳浴在使用過程中穩(wěn)定性的監(jiān)控,如果上述試驗(yàn)出現(xiàn)混濁時(shí)間明顯加快,說明化學(xué)鍍鎳浴處于不穩(wěn)定狀態(tài)。