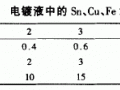
1.化學(xué)鍍銅液故障分析
通常采用硫酸銅作為化學(xué)鍍銅液的主鹽,還原劑有甲醛、次磷酸鈉、硼氫化鈉等,最常用的是甲醛。化學(xué)鍍銅溶液中為防止氫氧化銅沉淀還必須加入絡(luò)合劑和穩(wěn)定劑,酒石酸鹽是最常用的絡(luò)合劑,其他還有EDTA、三乙醇胺、硫脲等。化學(xué)鍍銅液中的Cu2+離子,被溶液中KNaC4H4O6絡(luò)合,在適當(dāng)pH值條件下,銅絡(luò)合離子被溶液中的甲醛還原為金屬銅,還原劑甲醛的還原能力隨pH值增高而增強(qiáng),只有在pH>11的堿性條件下,才具有還原銅的能力。若pH值過(guò)高,就容易造成化學(xué)鍍銅液的自分解,降低鍍液的穩(wěn)定性。當(dāng)鍍液中Cu2+離子含量很低,KNaC4H406含量很高時(shí),則Cu2+被KNaC4H406牢固的絡(luò)合,Cu2+離子就不容易被甲醛還原為金屬銅而難以得到完整的化學(xué)鍍銅層;反之,若鍍液中Cu2+離子的含量很高,KnaC4H406的含量很低時(shí),Cu2+離子在適當(dāng)pH值條件下就很容易被甲醛還原沉積,從而使鍍銅液渾濁,導(dǎo)致銅沉積層粗糙。
化學(xué)鍍銅反應(yīng)要消耗OH一,所以隨著化學(xué)鍍銅沉積過(guò)程的進(jìn)行,鍍液的 pH值會(huì)不斷降低,銅的沉積速度隨pH值增高而加快,鍍銅層外觀也得到改善。因此,化學(xué)鍍銅溶液pH值不能過(guò)低。但pH值過(guò)高,容易引起鍍液中甲醛的分解速度加快,副反應(yīng)加劇,消耗增大,銅層沉積速度不再增加,導(dǎo)致鍍液老化、自然分解。
2.化學(xué)鍍鎳液的故障分析
化學(xué)鍍鎳的溶液配方有很多,主要有弱酸性和弱堿性兩大類(lèi)。鎳鹽是鍍液的主要成分,一般是隨鎳鹽濃度的升高鍍層沉積速度加快。但在乳酸為絡(luò)合劑的鍍液體系中,隨著鎳鹽濃度的升高鍍層沉積速度變化不大。另外鎳鹽濃度過(guò)高,容易發(fā)生鍍液的自分解,從而減少鍍液的使用壽命。同時(shí),鎳鹽含量還受鍍液中絡(luò)合劑、還原劑比例的制約,因?yàn)殄円褐墟圎}含量提高也會(huì)降低鍍層中的含磷量。
次亞磷酸鈉是化學(xué)鍍鎳溶液的還原劑。其用量主要取決于鍍液中鎳鹽的含量。因?yàn)榇蝸喠姿徕c含量過(guò)高,反應(yīng)速度加快,得到的鍍鎳層色暗,鍍液易分解而不穩(wěn)定;含量過(guò)低,鎳的沉積速度慢,零件上氫容易析出而產(chǎn)生氣流和針孔。
化學(xué)鍍鎳的沉積速度隨溶液的pH值升高而加快,pH值過(guò)高,反應(yīng)過(guò)分劇烈,溶液容易分解而不穩(wěn)定;pH值過(guò)低,沉積速度很慢,甚至得不到鍍層。
在正常的反應(yīng)過(guò)程中,pH值會(huì)逐漸降低,同此應(yīng)經(jīng)常測(cè)定pH值,若pH值過(guò)低,可用氨水或NaOH調(diào)節(jié),若pH值過(guò)高,可用H2S04調(diào)低。