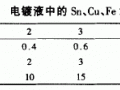
與電鍍過程直接有關(guān)的動力學(xué)知識是電極過程的動力學(xué)。而電極過程動力學(xué)的研究基礎(chǔ)是建立在金屬電極與溶液的雙電層理論之上的。 電解質(zhì)導(dǎo)電中的電子的交換是在電極表面進行的。無論是陽極還是陰極,在電解過程中,在電極上都有電子能量的交換。 電子能量到底是怎么樣在電極表面交換的呢?這就要引入雙電層的概念來加以說明。所謂雙電層,是指當(dāng)電極浸入到電解質(zhì)溶液中時,由于金屬電極表面的電荷密度高過溶液中分散的離子、或偶極子(比如極性分子水或其他有電荷傾向的溶質(zhì)分子)的電荷,這些溶液中的離子等會以相反的電荷在電極表面排列,形成一種與電極表面電荷極性相反的動態(tài)的雙電層。并且相應(yīng)地存在一定的電位差。根據(jù)形成雙電成的電荷載體的不同,雙電層可以分為離子雙電層、偶極子雙電層和吸咐雙電層。對于電沉積過程來說,重點要認(rèn)識的是離子雙電層。 離子雙電層有可能是在電極與電解質(zhì)溶液接觸后自發(fā)形成的,但也可能是在外電源作用下形成的。比如電沉積中所使用的電源。無論哪種情況下形成的雙電層,在性質(zhì)上是基本一樣的。 對于金屬電極來說,當(dāng)與電解質(zhì)溶液接觸時,在固相(金屬)和液相(電解質(zhì)溶液)之間會發(fā)生金屬離子在兩相間的轉(zhuǎn)移。這種轉(zhuǎn)移是動態(tài)的,當(dāng)進入溶液中的金屬離子達(dá)到一 定的量的時候,金屬表面的電子數(shù)就會增加,從而以庫倫力的作用使金屬離子在電極表面排列,并阻滯電極上的金屬離子進一步進入溶液。這就是自發(fā)形成的雙電層(參見圖1-1)。這種以電極金屬離子進入溶液的形式形成的雙電層,電極表面是負(fù)電性而溶液表面層則呈正電性。金屬鋅電極在含鋅離子的電解液中形成的雙電層就是這種性質(zhì)的雙電層。還有一種情況是金屬電極上金屬離子的化學(xué)位能比溶液中的低,這時當(dāng)金屬電極浸入到相應(yīng)的電解質(zhì)溶液時,溶液中的金屬離子會自發(fā)地沉積到電極上。比如金屬銅電極在硫酸鹽溶液中,溶液中的銅離子會向銅表面聚集,使電極表面正電荷增加,而使雙電層界面中的溶液一側(cè)呈電負(fù)性。 金屬進入到相應(yīng)的溶液中形成自發(fā)雙電層的速度非常快,可以說是瞬間完成的,大概只需要百萬分之一秒。 而在外電源作用下形成的雙電層則相當(dāng)于給一個平板電容器充電。由于電極表面雙電層之間的距離極近,在這個雙電層之間有很高的場強。可達(dá)1010V/m。而從電工學(xué)的角度可知,當(dāng)場強達(dá)到106V/m時,所有的電介質(zhì)都會因放電而被擊穿。由于雙電層之間的距離非常小,在兩極之間沒有介質(zhì)可以進入,因而不會引起介質(zhì)破壞的問題。 雙電層的這種特性可以使一些在通常情況下不能進行的化學(xué)反應(yīng)得以進行。又可以使電極過程的速度發(fā)生極大的變化。 例如界面間的電位差改變0.1~0.2V,反應(yīng)速度可以改變10倍左右。由此可知,電極過程的反應(yīng)速度與雙電層電位差之間有著非常密切的關(guān)系。 圖1-1電極在溶液中形成雙電層示意圖

以上圖書內(nèi)容由化學(xué)工業(yè)出版社提供,如需購買以上圖書或電鍍方面的其他經(jīng)典參考書請登入: http://book.dangdang.com/20130816_2115